前言
肝脏的功能高度依赖其精细的空间结构。门管区作为肝动脉、门静脉和胆管三者汇聚的枢纽,在营养交换、胆汁生成与排泄中的作用至关重要。胆汁流动失调或胆汁淤积与胆管连接失调会导致胆汁淤积性肝病,进而发展为纤维化、肝硬化,并最终导致肝功能衰竭。然而,长期以来学界始终缺乏能稳定重建该区域空间结构与细胞分布的体外模型。
传统肝脏类器官仅由上皮细胞(肝细胞或胆管细胞)组成,难以再现上皮细胞与门管间充质细胞间的相互作用,因此在探索门管区稳态或纤维化机制方面仍有不足。构建一种具备细胞多样性、空间组织性与疾病诱导能力的“类肝门管”模型已成为当下的迫切需求。
此前2025年5月29日,德国马普所曾与牛津大学等合作团队在顶刊Nature发文,共同构建了小鼠肝组合体,成功复现了肝脏门管区复杂的三维结构以及与胆管相关的纤维化病变[1]。不过,动物来源的模型在药物反应和代谢机制上仍然与人类存在显著差异。
2025年12月17日,马普所同一团队再次于Nature发表研究“Human assembloids recapitulate periportal liver tissue in vitro”,将该培养方案进一步扩大至人源模型,成功从28位不同患者的组织中建立了可长期扩增的人类肝细胞类器官(h-HepOrgs),并通过将其与胆管类器官、门管区间质细胞进行精准组装,构建了第一个人类肝门管区组装体,为肝脏疾病建模和药物研发开辟了全新维度[2]。

01 小鼠肝组合体的培养
此前的研究中,团队以小鼠原代肝细胞衍生的HepOrg为起点,通过在培养基中补充Wnt3A或Wnt替代物,将类器官的形成效率提升了2-3倍,并实现了体外长期维持。不过,优化后的HepOrg中仍然存在部分未嵌入肝细胞或与肝细胞形成生理连接的胆管细胞类器官,因此研究人员进一步更替了培养基,使用此前共培养胆管与门管间充质细胞的培养基(MM),发现获得的类器官中不仅肝细胞功能更为成熟、且门管周围基因表达水平也有所提升。该MM培养基同样也添加了Wnt3A作为支持。
接下来的目标是完全重建肝小叶门管区。研究人员利用摇动平台,将优化后的HepOrg与胆管类器官、门周间充质细胞按精确比例混合。这一过程的成功率高达90%,获得的多细胞结构即为“组合体”。该模型在中观尺度上精准复现了天然组织布局:具有开放管腔的胆管被门管间充质细胞包围,并嵌入在肝细胞实质中。
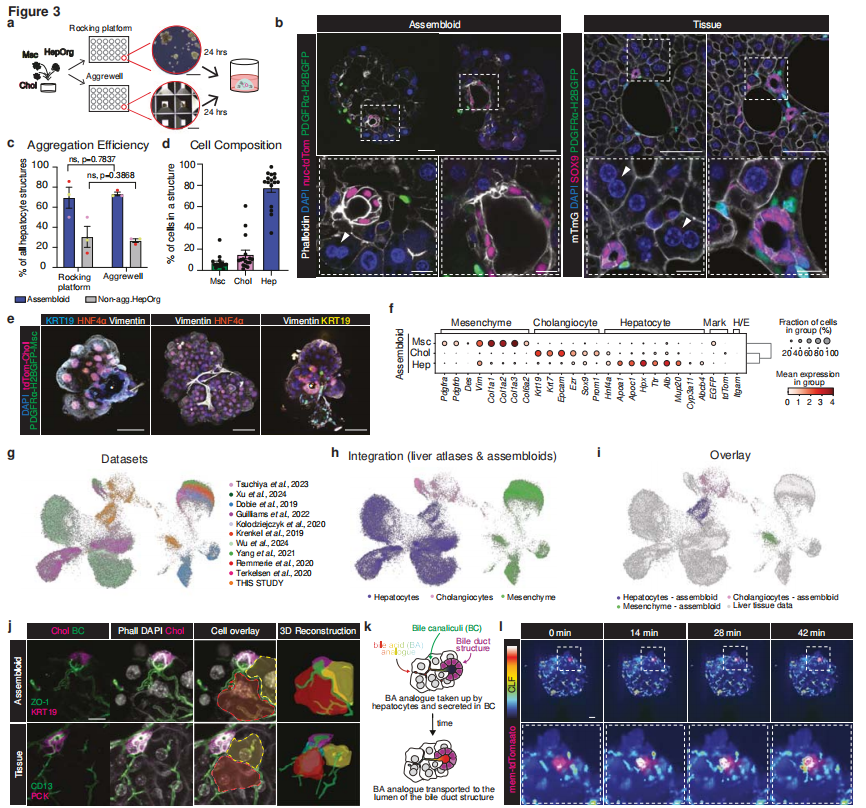
图:组装体复刻了小鼠原代组织的结构与基因表达
02 从28位患者中建立可长期扩增的人类HepOrgs
接下来,研究团队试图将培养方案移植到人源类器官中。同样遵循循序渐进的思路,先培养可长期扩增的人类肝细胞类器官(h-HepOrgs),而后再尝试与胆管类器官、门管区间质细胞进行三位一体的组装。
聚焦WNT的培养方案
长期以来,原代人类肝细胞在体外培养中极易失去表型并迅速死亡,这严重限制了其在疾病建模中的应用。本研究首先通过两步胶原酶灌注法从患者肝组织中获取细胞。在筛选培养基的过程中,研究人员通过分析肝癌类器官和部分肝切除后再生组织的转录组数据,识别出WNT和YAP信号通路是促进肝细胞退出静止期并进入增殖状态的关键。因此,类似于小鼠HepOrgs培养方案,Wnt3A 或 Wnt 替代物同样是h-HepOrgs培养基中的“标配”。
通过在基础培养基中添加WNT替代物(WntS)和LATS1/2抑制剂(TRULI),研究团队成功诱导了肝细胞类器官的形成。更具突破性的是,研究人员发现移除培养基中的烟酰胺能使类器官的形成效率显著提升近10倍。此外,与小鼠培养方案不同的是,由于人类肝细胞在体外极易去分化,为了维持其表型,人类方案通常需要更复杂的营养组合,包括特定的人类重组生长因子(如 HGF、hEGF、FGF10、FGF7)以及针对性的小分子抑制剂(如 TGF-β 抑制剂A83-01)),以防止细胞在培养过程中发生纤维化或转化为无功能的成纤维细胞。
由于人类的胆汁代谢路径更复杂。为了确保人类组合体能够实现“胆汁引流”,当类器官扩增到一定阶段后,再降低 Wnt 信号强度,并加入地塞米松,以促进肝细胞的代谢成熟,并增强了细胞间紧密连接的形成,还有助于形成微细的胆小管网络,以期未来整合胆管类器官后转运和代谢胆汁酸。
最终,在优化的EM2培养基中,团队成功从28位年龄跨度为11至85岁的患者(包括5份冻存肝细胞样本)中100%成功建立了h-HepOrgs。这些类器官表现出极强的扩增能力,能够以1:2的比例每周传代,持续扩增超过3个月(10代以上),且在长期培养过程中始终保持稳定的染色体数目。
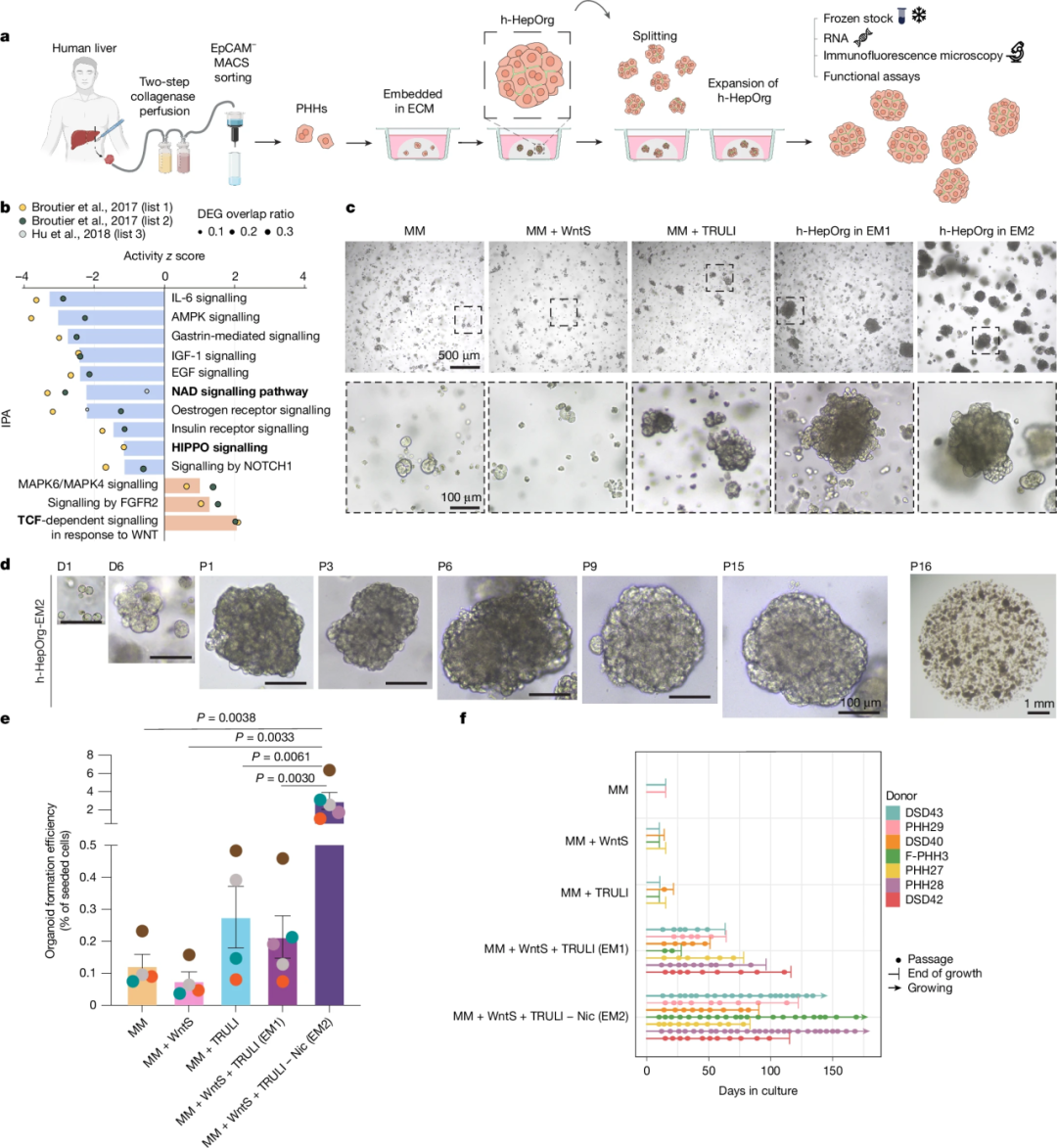
h-HepOrgs可长期扩增
精准复刻三维胆管结构,复现跨尺度功能维持
h-HepOrgs不仅在数量上实现了突破,在结构和功能上也表现出对体内肝组织的深度复刻。转录组分析显示,扩增态的h-HepOrgs具有显著的增殖特征,其基因表达谱与肝切除后的再生组织高度相似。当类器官转入分化培养基(DM)后,其增殖标志物Ki-67的表达迅速下降,而功能性肝细胞标志物显著上调。
在微观结构上,h-HepOrgs能够形成类似于体内组织的细长三维胆管结构,这些胆小管表面表达CD13、ZO-1和radixin等极性标志物。功能测试进一步证实,分化后的h-HepOrgs在白蛋白分泌能力和细胞色素P450活性(如CYP2C9)方面,与体外培养7天的原代肝细胞相当。值得注意的是,在维拉帕米代谢实验中,h-HepOrgs产生主要代谢产物去甲维拉帕米的能力甚至超过了培养1天的原代肝细胞,这反映了其内部复杂的CYP酶系(如CYP2C8、CYP3A4/5)的高度协调性。
此外,该平台还捕捉到了不同患者间的代谢差异,展示了其在个性化药物代谢研究中的巨大潜力。
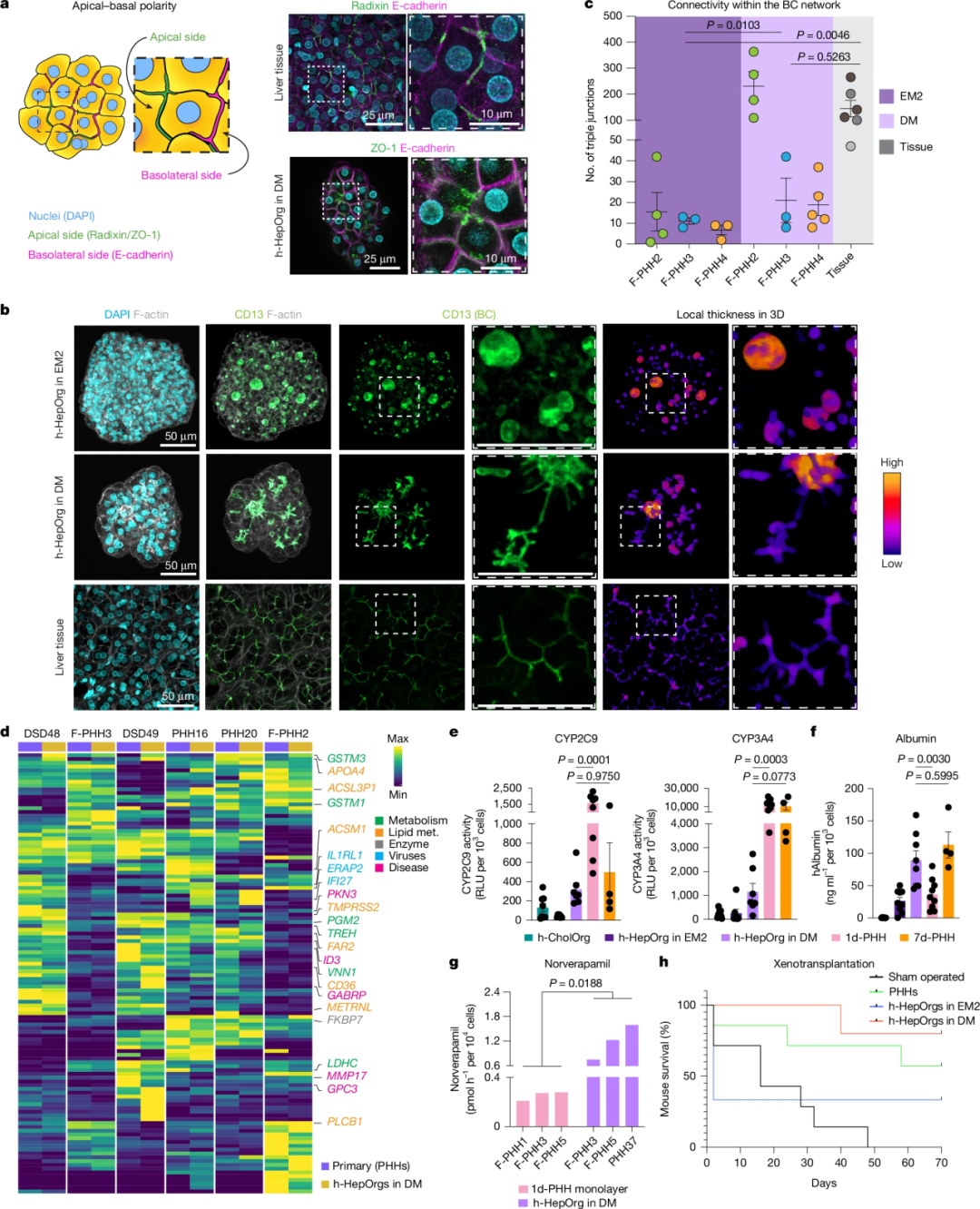
h-HepOrgs 保持体内功能和患者特异性特征
体内验证:挽救致命性肝病模型的治疗潜能
为了评估这些体外扩增细胞的生物学效能,研究团队将其移植到了I型酪氨酸血症(Fah-/-Rag2-/-Il2rg-/-)小鼠模型中。实验结果显示,移植后的h-HepOrgs细胞能够成功植入小鼠肝实质,并维持正常的肝细胞功能。
在关键的生存率测试中,注射了50万个h-HepOrgs细胞(无论是扩增态还是分化态)或原代肝细胞的小鼠,在撤除NTBC药物后,其生存曲线显著优于对照组。这些移植细胞成功挽救了小鼠的致命性表型,证明了通过该技术扩增的肝细胞在组织工程和细胞治疗领域具有极高的临床转化价值。
03 更高维度的协同:构建第一个人类肝门管区组装体
肝脏的生理功能不仅依赖于肝细胞,更取决于多种细胞间的空间排布和信号交流。该团队下一步的目标是重建肝小叶的门管区。思路与小鼠肝脏组装体类似:将肝细胞类器官、胆管类器官和门管区成纤维细胞按照特定比例进行组装。
胆管类器官培养方案
由于胆管类器官的生长极度依赖于 Wnt 和 Notch 信号通路的协同作用,研究团队还添加了R-spondin 1、FGF10、EGF、HGF、烟酰胺、TGF-β 抑制剂(A83-01)以及福司可林以诱导管腔扩张,并增强胆管细胞的分泌功能。
门管区成纤维细胞优化
此前的小鼠方案使用的是通用的门管周围间充质细胞。但在人类中,间充质细胞往往直接取自同一患者的活检组织。这是因为人类的纤维化反应具有高度个体差异。通过调节人源间充质细胞的比例和活化状态,研究者可以更真实地模拟人类特有的病理过程,如 Alagille 综合征中的导管发育不全。
组合体培养方案
此外,为了使组装体尽可能接近体内真实比例,团队通过量化发现肝组织中胆管细胞、门管区成纤维细胞和肝细胞的比例约为 15% : 8% : 77%。基于此,他们将1个肝细胞类器官与约100个胆管细胞和25个成纤维细胞混合。
组装体对肝脏门管区组织的模拟能力
在AggreWell平板中培养24小时后,三种细胞自发组装成紧凑的复合结构,并在培养6至16天后形成了稳定的门管区样排布:胆管细胞构成的管腔处于中心或特定的功能单元内,其基底侧被门管区成纤维细胞(PFs)精密包裹,形成一层薄薄的间质支撑层。最后,这一胆管-间质复合体被厚实的人原代肝细胞实质所包围。这种由内向外的“胆管-间质-肝实质”层级结构,完美复现了天然肝小叶门管区的典型解剖布局。
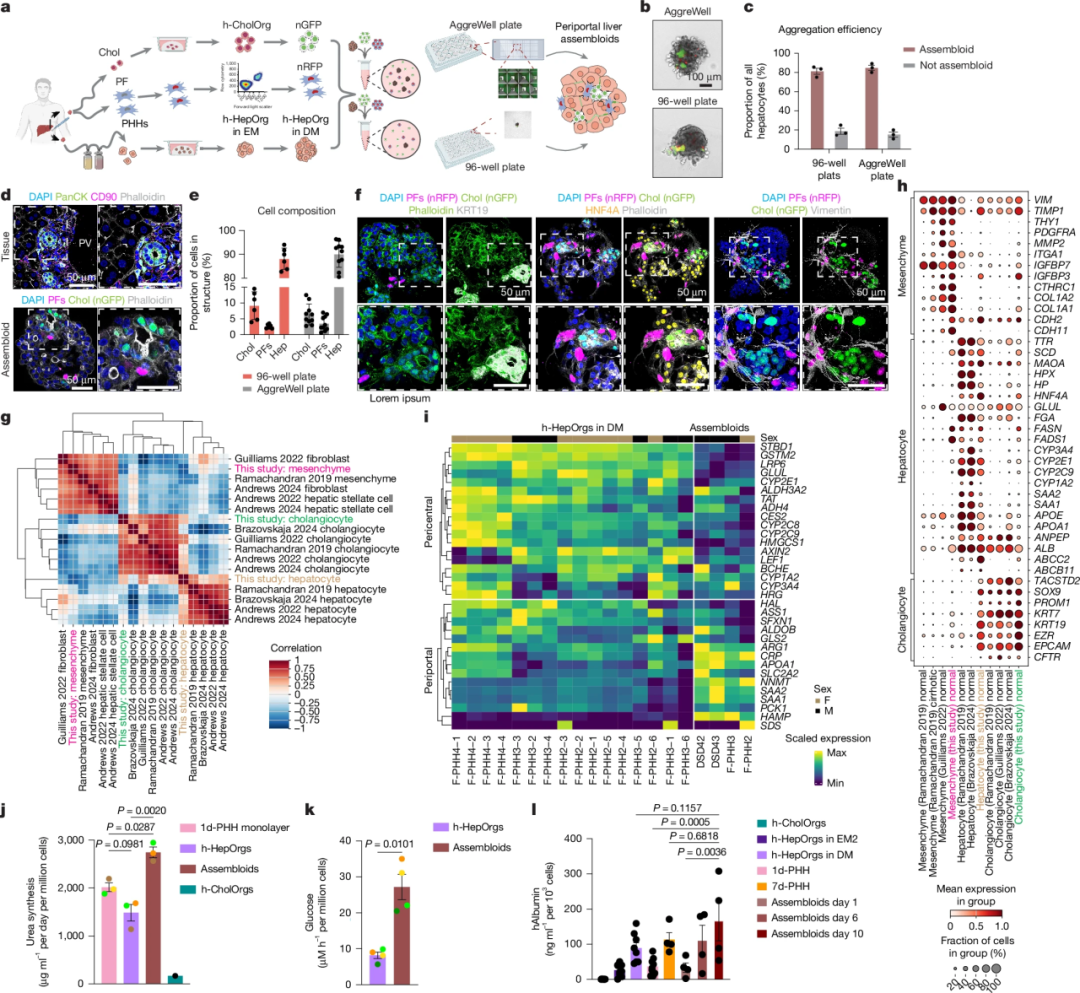
人类门周组装体重现了体内肝脏门周组织
在生理功能上,通过荧光示踪证实肝细胞内的微观胆小管网络已与胆管类器官的大型管腔成功“对接”,实现了从肝细胞到胆管的完整胆汁引流通路;
分子水平的单细胞测序进一步显示,组装体中的肝细胞特异性增强了如 CYP2F2 等门管周围区标志基因的表达,展现出明确的空间区室化特征;
同时,研究团队还验证了成纤维细胞与胆管细胞间通过 Jagged1-Notch 等信号通路进行的复杂细胞互作,这种对话维持了组织的结构稳态;
最后,在代谢表现上,组装体的尿素生成、糖异生和白蛋白分泌能力(均为门静脉功能)显著优于单一类器官模型,并能高度仿真胆管扩张等纤维化病理反馈,从而在解剖、分子、生理及病理四个层面完成了对门管区微环境的系统性还原。
04 疾病建模:揭示胆管纤维化的病理机制
这一高度仿生的组装体平台为研究复杂的肝脏疾病提供了理想工具。研究团队通过将成纤维细胞的比例增加20倍(即1个肝细胞类器官对应500个成纤维细胞),构建了“纤维化样”组装体。在这种病理模型中,研究人员观察到了典型的纤维化特征,包括TGFβ信号通路的显著激活,这与原发性硬化性胆管炎(PSC)和原发性胆汁性肝硬化(PBC)患者的转录组特征高度吻合。
形态学上,纤维化组装体出现了明显的囊性病变,类似于患者组织中的导管反应。更深入的免疫荧光分析发现,在纤维化环境下,部分肝细胞(HNF4A+)开始表达胆管细胞标志物KRT19,并形成了管腔结构,这揭示了在过度间质挤压下肝细胞向导管细胞转分化的潜在病理过程。此外,模型还成功模拟了纤维化过程中常见的TNF、IL-4和IL-6信号富集以及肝细胞凋亡增加等特征。
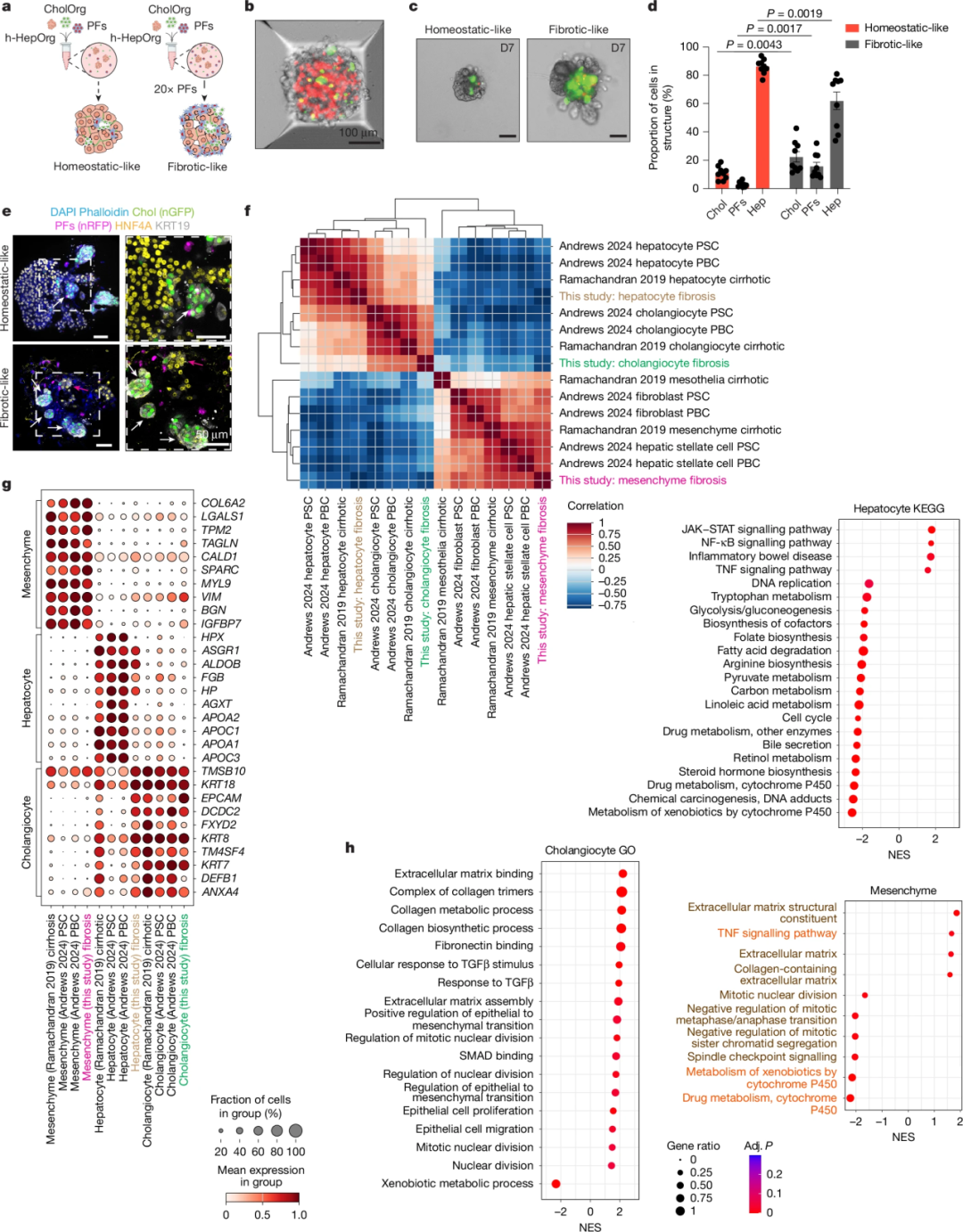
组装体模拟人类胆道纤维化的某些方面
05 总结
Meritxell Huch团队的这一研究成果标志着肝脏体外建模从“单细胞类型类器官”迈向了“多细胞复杂组装体”的新阶段。通过建立包含28位捐赠者的活体类器官库,研究者可以更深入地探索个体差异对肝脏再生、代谢和疾病进展的影响。
这种能够精准复刻人类门管区组织架构的组装体系统,不仅为解开胆管纤维化等慢性肝病的分子机制提供了新平台,也为药物筛选和毒性测试提供了比动物模型更具人体相关性的选择。随着技术的不断成熟,这一平台有望在加速创新药物研发、实现早期精准诊断以及推动个性化医疗领域发挥核心作用,为全球数以百万计的慢性肝病患者带来新的希望。
近岸蛋白相关产品
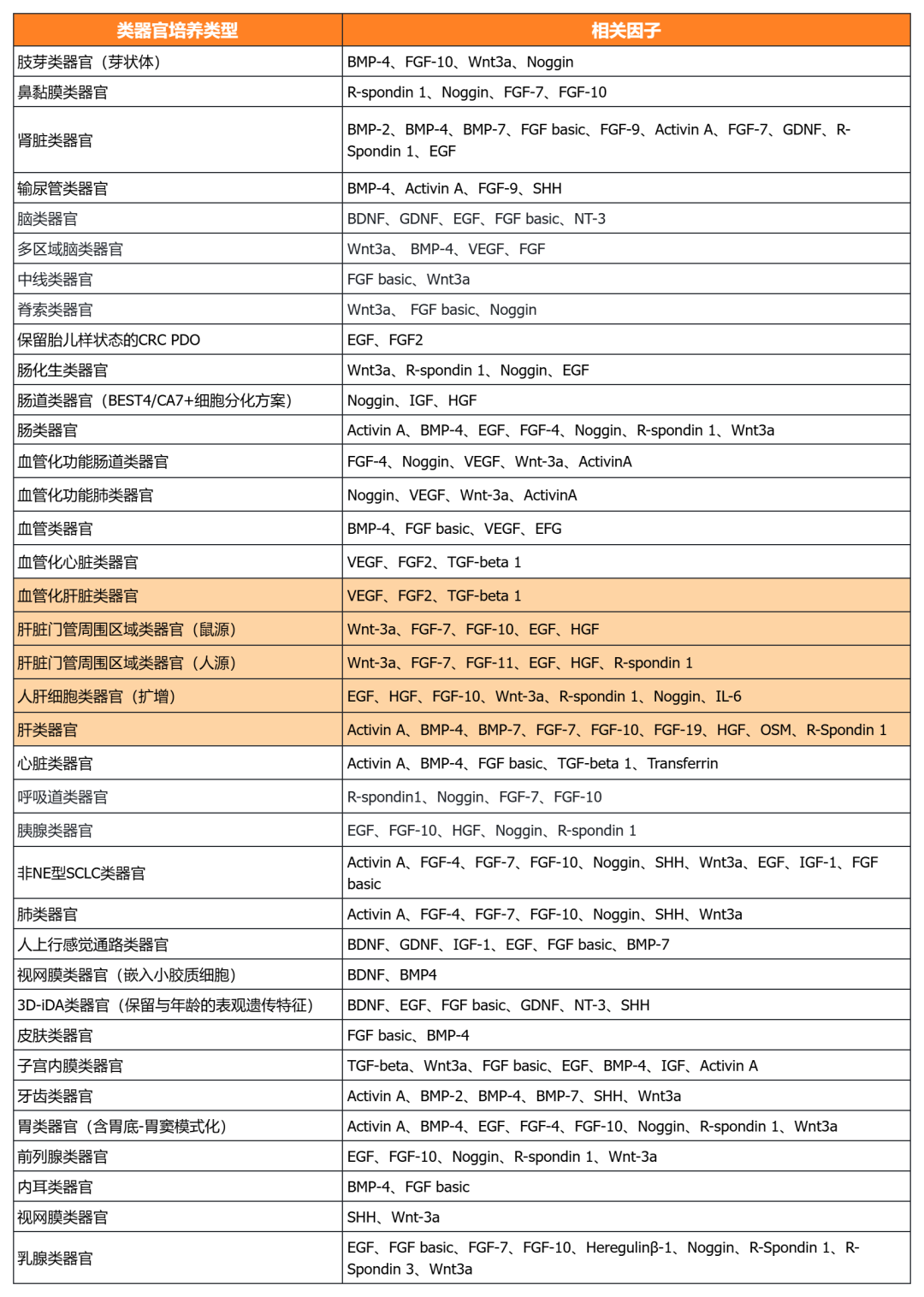
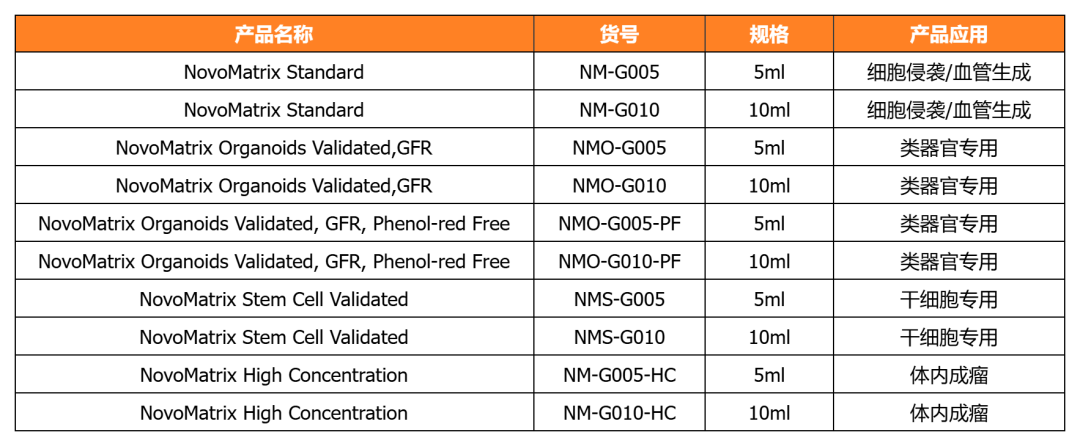
近岸蛋白提供多种类器官体外培养全方案,包括基质胶、培养基、相关细胞因子等:
经类器官培养验证的完全培养基
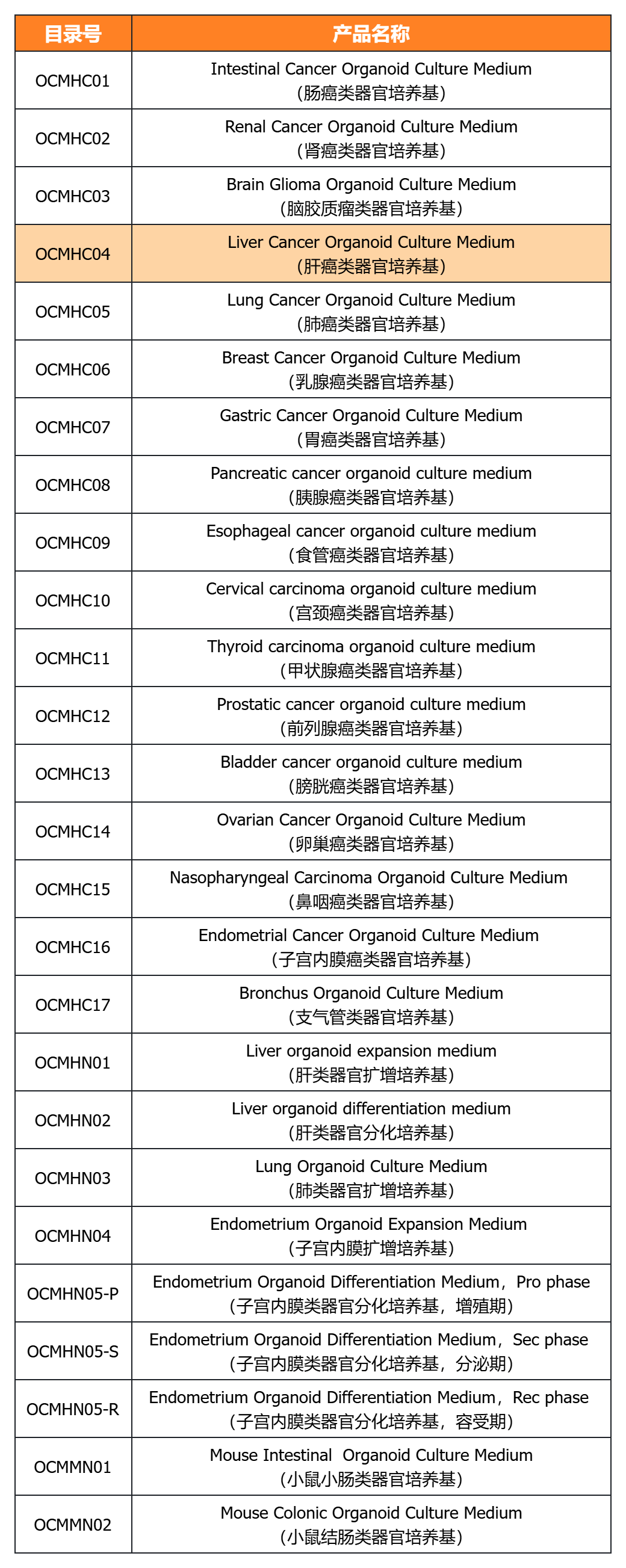
经类器官培养验证的细胞因子
NovoMatrix 基质胶
参考资料
1. Dowbaj, Anna M et al. “Mouse liver assembloids model periportal architecture and biliary fibrosis.” Nature, 10.1038/s41586-025-09183-9. 29 May. 2025, doi:10.1038/s41586-025-09183-9
2. Yuan L, Dawka S, Kim Y, et al. Human assembloids recapitulate periportal liver tissue in vitro. Nature. Published online December 17, 2025. doi:10.1038/s41586-025-09884-1
