快速出方案,高性价比,短周期交付
胶质母细胞瘤(GBM)因其高度恶性与治疗困难,被视为实体瘤治疗中的主要难题之一,其对各类免疫疗法普遍表现出显著抵抗。以往基于HSV的溶瘤病毒疗法在GBM中效果有限,关键原因在于:其一,多数肿瘤细胞缺乏HSV的天然受体,导致病毒难以有效感染;其二,肿瘤微环境处于深度免疫抑制状态,致使T细胞、NK细胞等免疫细胞功能受限,即使病毒能引起部分肿瘤细胞溶解,也难以激发有效的全身抗肿瘤免疫反应。
2025年12月,哈佛医学院研究团队在《Nature Cancer》(IF=28.5)发表了一项创新研究。该研究不再局限于直接杀伤肿瘤细胞的传统思路,而是通过对HSV溶瘤病毒进行系统改造,将其设计为一种能够特异性靶向肿瘤、激活免疫应答并改善肿瘤微环境的“多功能免疫调控平台”,从而为GBM的免疫治疗提供了新的策略方向。

针对胶质母细胞瘤难以被传统溶瘤病毒感染的难题,研究团队发现该肿瘤细胞普遍缺乏HSV-1病毒所需的天然受体,导致病毒无法有效进入。为此,他们选取了裂解能力较强的HSV-1 MacIntyre毒株,构建了一个便于基因编辑的病毒平台。通过对病毒包膜蛋白进行改造,删除了原有的受体结合区,并引入了能够特异性识别肿瘤标志物(如EGFR和整合素)的靶向模块,从而使病毒能更精准地结合胶质母细胞瘤细胞。实验结果显示,这种经过重定向设计的病毒在多种肿瘤细胞系中,尤其是LN229细胞中,展现出明显提升的感染与复制能力。
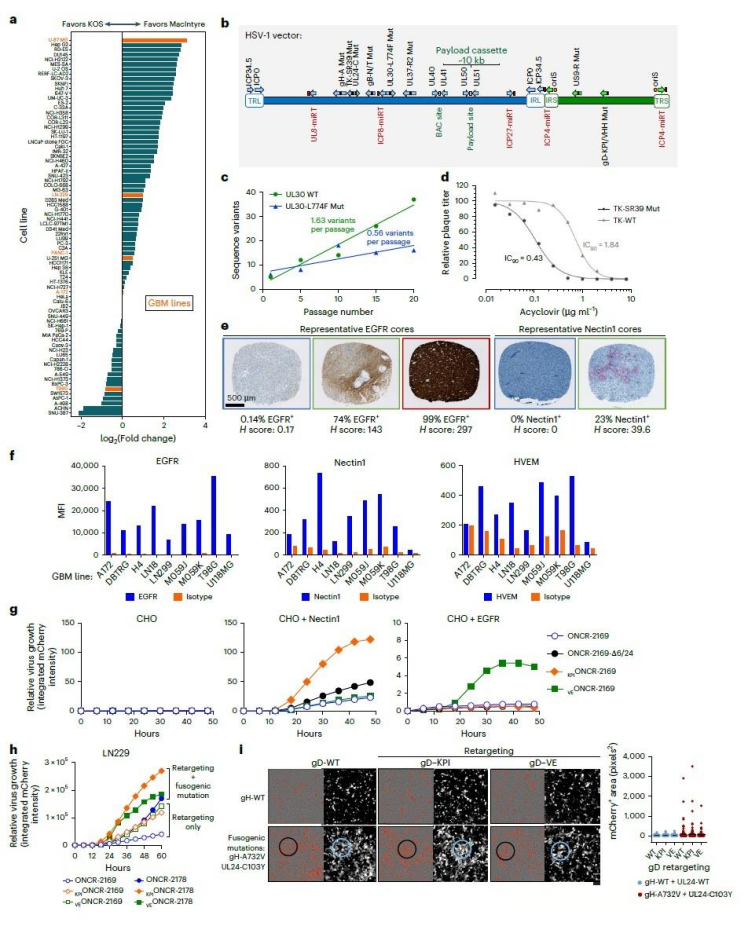
在确保病毒特异性靶向肿瘤的基础上,该研究进一步增强了其在瘤内的扩散能力与安全性。通过引入特定突变,有效提升了病毒在肿瘤细胞间的直接传播效率,避免了传统改造可能产生的缺陷颗粒,从而在实验中实现了更优的横向扩散效果。与此同时,研究构建了一套基于miRNA的调控开关:将一组在正常脑组织中高表达而在胶质瘤中低表达的miRNA识别序列,嵌入病毒关键基因中。这使得病毒在正常细胞内复制受到严密抑制,而在肿瘤细胞内则能顺利增殖,构成了高效的特异性安全屏障。再辅以阻断病毒沿神经迁移的基因改造,最终在动物模型中实现了病毒在瘤内有效扩增,同时对健康脑组织几乎不产生毒性。
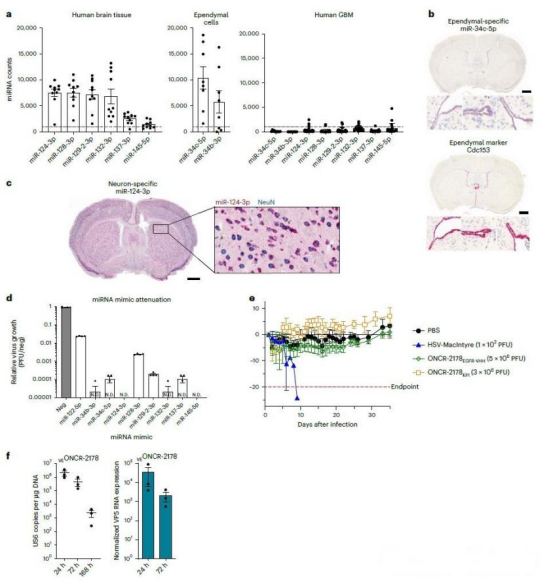
在实现靶向与安全的基础上,该研究进一步将病毒改造为调控肿瘤免疫微环境的关键工具。通过使其表达包括IL-12、抗PD-1抗体在内的多种免疫调节因子,可协同解除T细胞、巨噬细胞等多重免疫抑制。动物实验表明,这种多功能病毒能显著延长模型动物的生存期,其中IL-12与抗PD-1的组合显示出最优的协同疗效,并能激发长期的免疫记忆,标志着其从传统的裂解工具升级为可系统重塑免疫微环境的治疗平台。
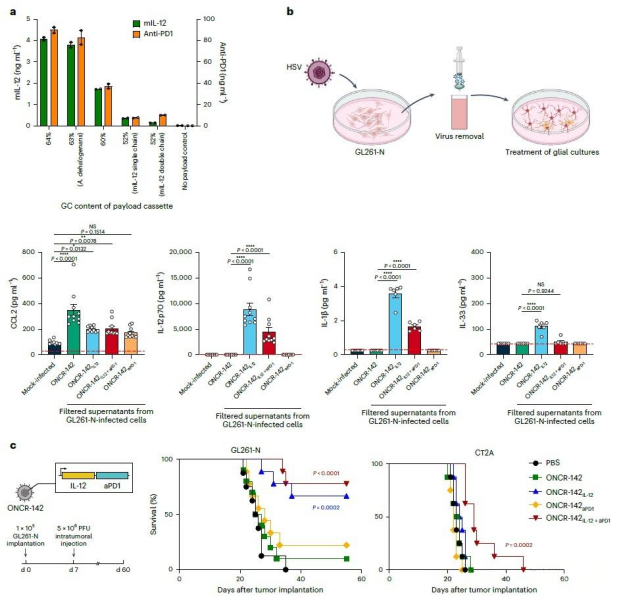
该疗法可重塑肿瘤免疫微环境,包括促进细胞毒性T细胞浸润、激活巨噬细胞与NK细胞,并抑制免疫负向通路。这些变化共同逆转了免疫抑制状态,与显著的肿瘤控制及生存改善直接相关。
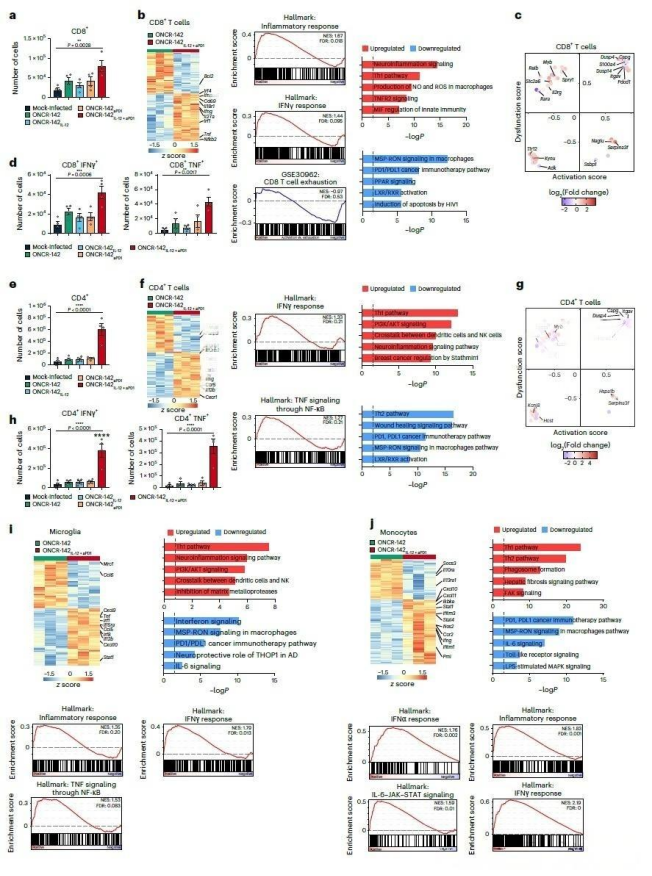
研究人员构建的多功能工程化病毒,在多种模型中展现出持久的抗肿瘤效果。其核心机制在于对免疫微环境进行系统性调整:不仅能激活T细胞功能、增强NK细胞杀伤力,还将肿瘤相关巨噬细胞重编程为促炎表型,并通过清除抑制性介质维持整体的免疫活跃状态,从而实现对肿瘤的长效控制。
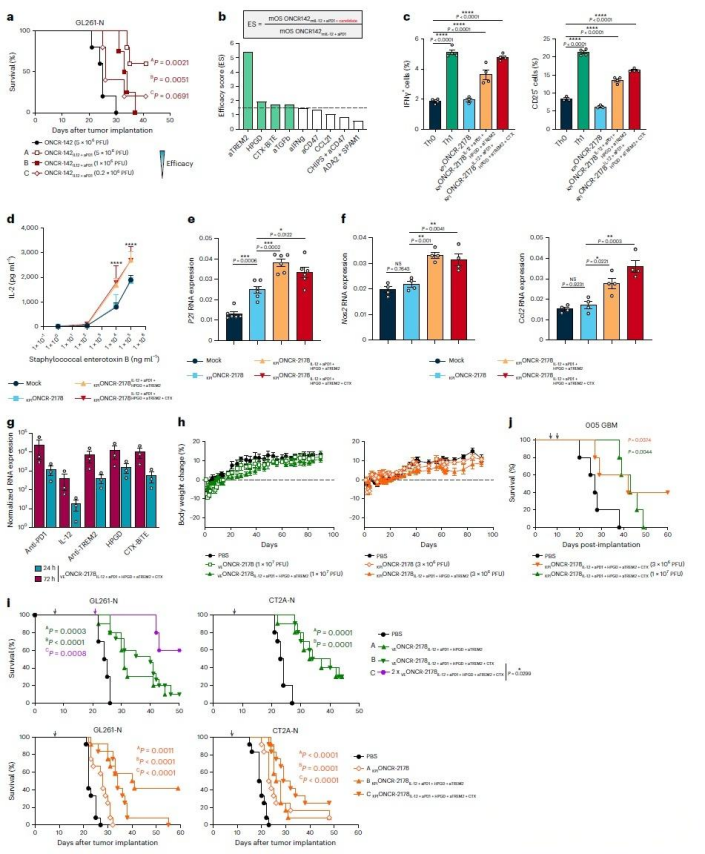
这项工作的核心进展在于,将溶瘤病毒从传统的肿瘤裂解剂,转变为一个能够协同调控多类免疫细胞的功能平台。该设计不仅实现了对肿瘤的高效靶向与体内安全性,更通过在瘤内局部释放多种免疫调节因子,系统性重塑肿瘤微环境,将其从免疫抑制状态逆转为免疫激活状态。这为胶质母细胞瘤等难治性肿瘤提供了新的治疗思路。此类可灵活组合功能模块的病毒平台,也为未来定制化免疫疗法开辟了可能。
这项前沿研究清晰地展示了工程化溶瘤病毒平台的巨大潜力,而将这样的创新理念转化为现实,则离不开强大的技术平台与高效的研发支持。这正是「DIFF CRO」的价值所在。
「DIFF CRO」溶瘤病毒构建与药效评价服务
DIFF CRO凭借其特色的重组病毒载体平台,提供从病毒载体构建、改造、扩增纯化到临床前药效学评价的一站式、高效率CRO服务。公司通过对病毒株基因组进行精准改造,以提升溶瘤病毒的抗肿瘤活性,并凭借优化的流程实现快速的方案输出和显著缩短研发周期。
服务内容: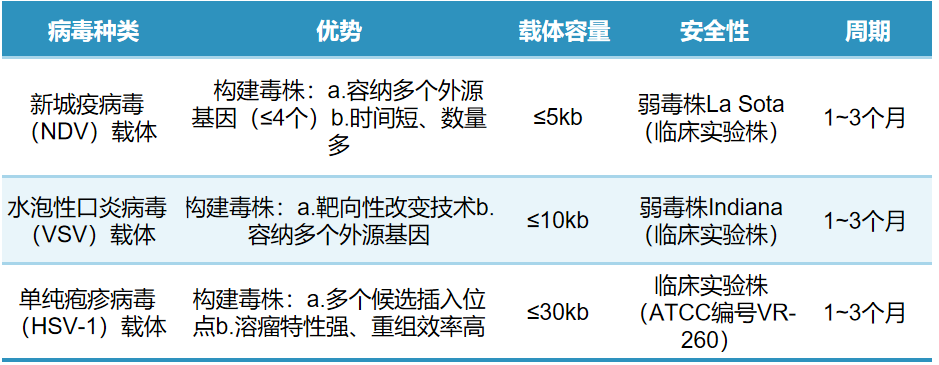
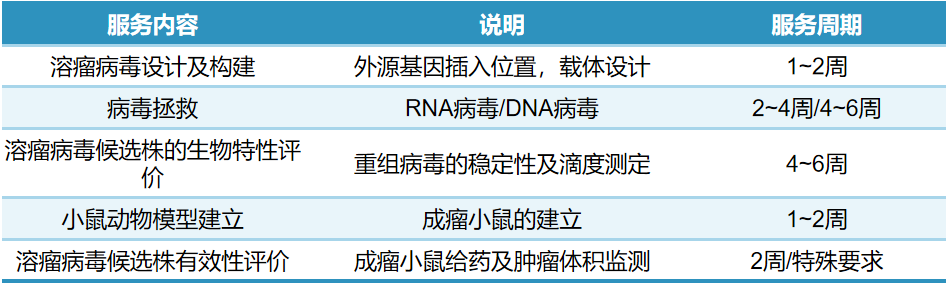
溶瘤病毒载体类“闭环式”持续开发能力
「DIFF CRO」依托全球领先的反向遗传操作技术平台,建立了独特的‘闭环式’持续开发能力。平台采用模块化的DCVL(设计-构建-验证-学习)循环,不仅能持续迭代优化病毒载体,更确保了服务流程的高度标准化和高效性,从而为客户带来高性价比的研发体验。
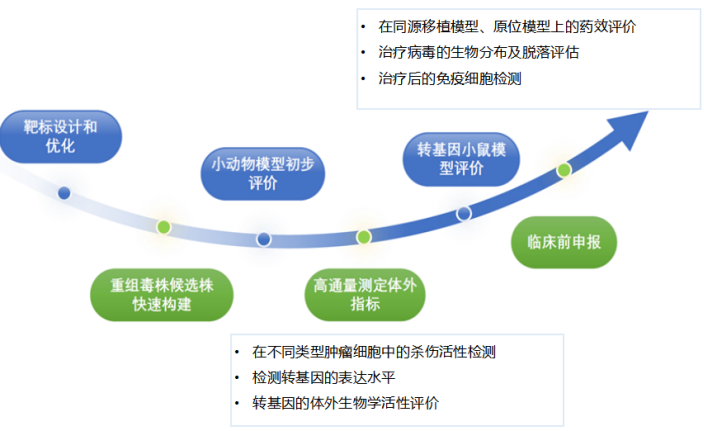
服务案例1:以VSV载体为例
水疱性口炎病毒(VSV)天然具有嗜神经性。「DIFF CRO」通过替换VSV的G蛋白,有效去除其神经毒性,显著提升安全性。同时,在基因组中插入特定细胞因子,使病毒在感染肿瘤细胞后能局部释放免疫因子,强力激活抗肿瘤免疫,实现“溶瘤”与“免疫”双重增效。
DIFF VSV载体优势:

体外药效验证:展现广谱杀伤潜力
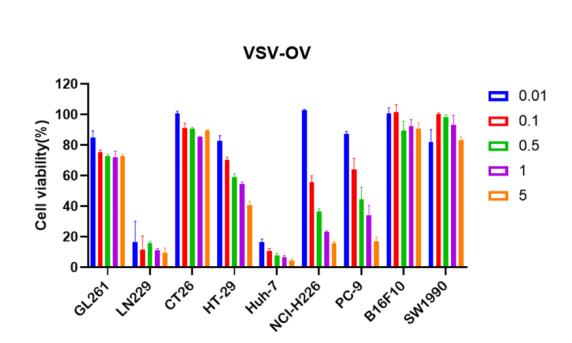
图1.VSV-OV在体外药效实验中对多种肿瘤细胞具有抑制活性
「DIFF CRO」研发团队构建的VSV-OV在体外药效试验中对胶质瘤、结直肠癌、肝癌、肺癌等多种肿瘤细胞系均显示出强大的直接杀伤活性。
体内药效确证:在不同动物模型中获得卓越肿瘤抑制效果
利用CT26小鼠移植瘤模型,VSV OV给药治疗后,大部分小鼠达到完全缓解(CR),8周后re-challenge实验(在同一部位用同样数量的肿瘤细胞系进行荷瘤),暂未观察到CR小鼠再次长瘤(对照组小鼠荷瘤时年龄与VSV-OV给药组小鼠相匹配,为20周龄), 体现出持久免疫保护效果。
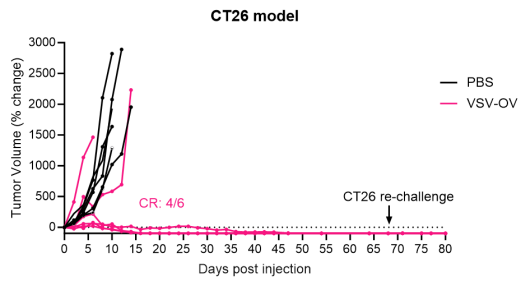
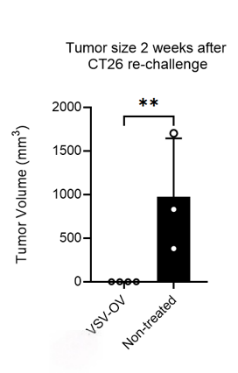
图2.VSV-OV在CT26小鼠移植瘤模型中具有抑制活性以及持续的免疫保护效果
服务案例2:以NDV载体为例
除对VSV载体进行改造外,「DIFF CRO」也可对NDV,HSV-1等载体进行改造,以NDV载体为例构建溶瘤病毒株候体内药效评价:
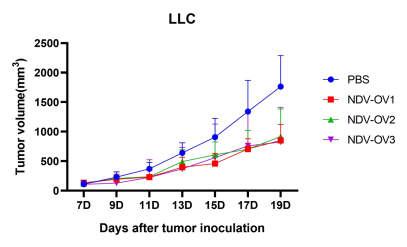
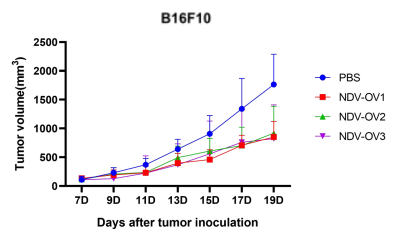
图3. 以NDV为载体的改造溶瘤病毒候选株(NDV-OV1,NDV-OV2,NDV-OV3)给药后,成瘤小鼠肿瘤生长相较于空白对照组被显著抑制。A:LLC成瘤小鼠;B:B16F10成瘤小鼠。
公司拥有符合P2生物安全标准的专用动物实验室,致力于为创新药企提供省时省力的一站式解决方案,显著缩短研发周期,为IND申报提供坚实、可靠的数据支持。选择「DIFF CRO」的一站式溶瘤病毒开发平台,即是选择一条更高效、更经济的研发路径。我们凭借快、省、全的服务优势,为您提供从开发到IND申报的可靠数据支持,共同加速突破!
参考文献:
Giovannoni, F., Strathdee, C.A., Faust Akl, C. et al. Retargeted oncolytic viruses engineered to remodel the tumor microenvironment for glioblastoma immunotherapy. Nat Cancer, 1994–2010 (2025).
